La Chirurgie Robotique : utile ou futile
Professeur Patrick Pessaux
La chirurgie robotique représente une des innovations technologiques marquante de ces 10 dernières années. Le terme robot est issu des langues slaves signifiant « esclave » ou « travailleur », initialement utilisé par l’écrivain tchécoslovaque Karel Čapek dans sa pièce de théâtre R. U. R. (Rossum’s Universal Robots) en 1920. Alors que les « robots » de Karel Čapek étaient des humains organiques artificiels, le mot robot fut emprunté pour désigner des humains « mécaniques » : une machine capable de travailler de façon autonome avec une structure physique similaire à celle humaine. En fait, l’idée originelle de « Robot » peut être attribuée à Leonardo Da Vinci, artiste et innovateur italien, qui en premier avait décrit et construit un modèle de combattant en métal avec une apparence humaine.
En dehors des applications industrielles et militaires, le concept de l’aide d’un système robotique adapté à la chirurgie est né à la fin des années quatre-vingt avec comme objectif principal d’améliorer la capacité humaine pour des interventions techniquement difficiles et minutieuses. Le système Zeus en 1998 puis le système Da Vinci en 2000 ont été les premiers outils robotiques disponible en chirurgie. Cette technologie dérive en fait directement de projets menés par l’armée américaine dont le but était de réaliser des interventions à distance des théâtres de conflits évitant ainsi la nécessité d’une équipe chirurgicale sur place. En effet, il s’agit de « télémanipulation » plutôt que de « robotique » : il ne s’agit pas de faire réaliser certains gestes préprogrammés par une machine mais de transmettre des mouvements réalisés par le chirurgien.
La chirurgie robotique a exploité les champs ouverts par la chirurgie mini-invasive représentée par l’avènement de l’abord coelioscopique. L’école chirurgicale française à jouer un rôle important dans le développement et la promotion de cette nouvelle voie d’abord. Pratiquement toutes les interventions en chirurgie abdominale ont été rapportées comme faisable par coelioscopie, de la simple cholécystectomie jusqu’à des résections coliques, rectales, ou pancréatiques. L’approche coelioscopique a permis une diminution des douleurs post-opératoires, une réhabilitation plus précoce, une réduction de la durée d’hospitalisation, et bien sur un moindre préjudice pariétal et donc esthétique. Il est aussi attendu un bénéfice en terme de réduction des coûts. Ces avantages ont pour certains auteurs un intérêt aussi en pathologie cancéreuse où une réhabilitation précoce peut signifier un plus court délai entre l’intervention et l’administration d’une thérapie adjuvante complémentaire (chimiotherapie – radiothérapie).
Cependant les interventions cœlioscopiques requièrent une expertise et une courbe d’apprentissage. De ce fait, son indication pour certaines interventions complexes reste limitée et réservée à certaines équipes expertes. La coelioscopie a des contraintes techniques. Le chirurgien a une vision du champ opératoire restreinte à deux dimensions avec une perte du sens de la profondeur. Les instruments utilisés sont rigides avec des mouvements limités à cinq degrés de liberté. L’ergonomie est précaire pouvant être responsable d’une plus grande fatigabilité et d’une perte de la précision du geste chirurgical. Le concept de la robotique naît de la nécessité de outrepasser les contraintes techniques de la coelioscopie tout en conservant ses avantages permettant ainsi d’en augmenter les indications.
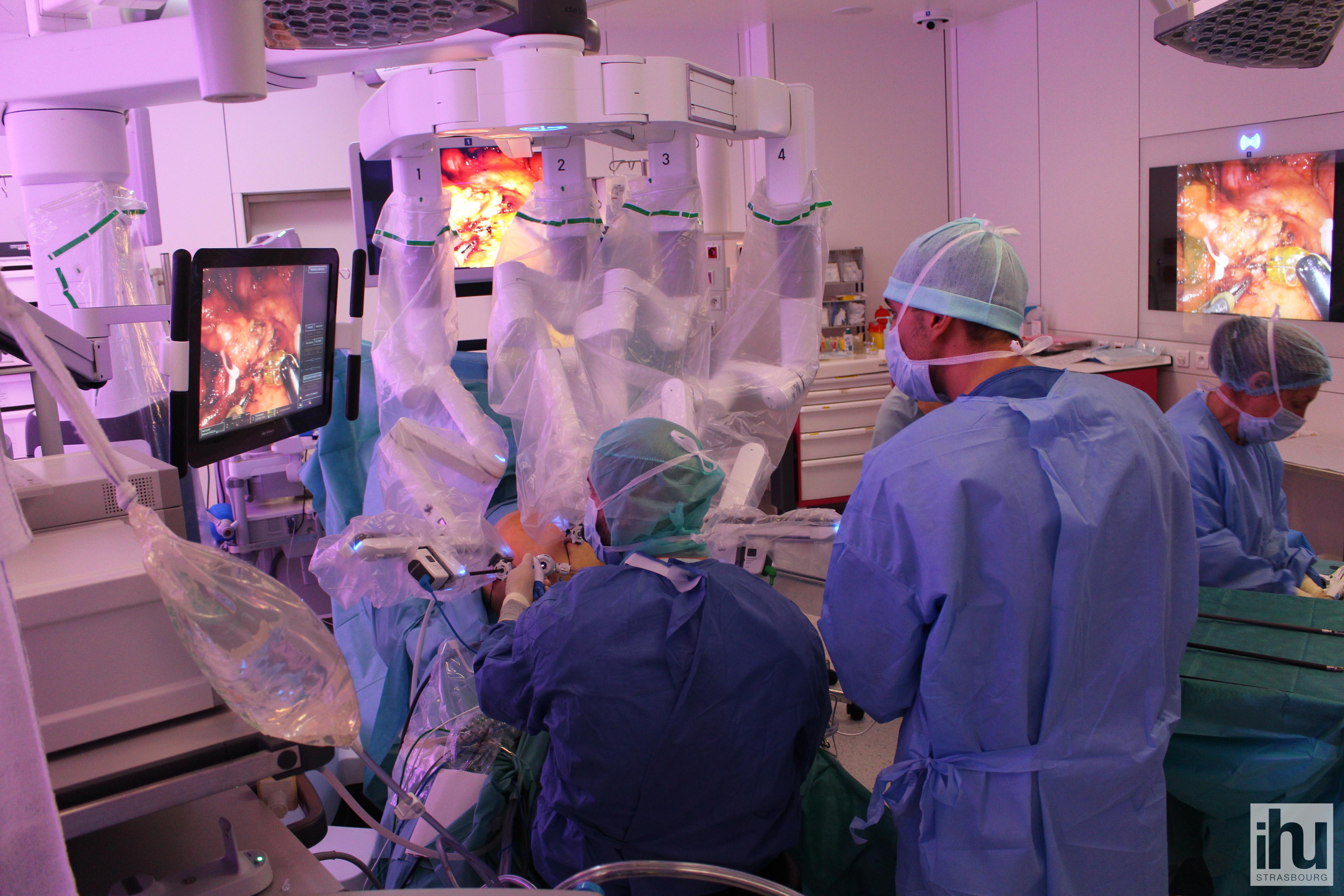
Le système chirurgical Da Vinci (Intuitive, Sunnyvale, California)( Figure 1) est composé de deux modules : la console et le cadre robotique. La console robotique représente le vrai centre de commande du système où le chirurgien est assis pour réaliser l’intervention, assurant un confort à l’opérateur. Le mouvement de ses mains sont transmis aux instruments placés au sein du champ opératoire à l’aide de 2 « joysticks ». Le système permet au chirurgien de moduler l’amplitude de ses gestes avec une réduction de l’échelle des mouvements (de 1 pour 1, 1 pour 3, à 1 pour 5), fonctionnalité adaptée aux procédures les plus fines et précises. Le tremblement naturel de la main humaine est éliminé totalement par un système de « tremor filtering ». La vision du champ opératoire est obtenue par l’intégration de deux différents systèmes optiques assurant ainsi une vision tridimensionnelle et magnifiée par l’utilisation d’un « zoom ». Le cadre robotique est constitué par un squelette mécanique avec quatre bras aux extrémités desquelles sont connectés les instruments chirurgicaux. Ces instruments sont introduits à travers la cavité abdominale par l’intermédiaire de trocarts similaires à ceux utilisés en coelioscopie mais d’un diamètre de 8 mm. Ces instruments assurent les mêmes degrés de liberté que la main humaine c’est-à-dire 7 degrés de liberté.
Les avantages techniques du système robotique ont permis la diffusion de l’abord mini-invasif aux interventions les plus difficiles. L’exemple classique est représenté en urologie par la prostatectomie radicale. En environ 5 ans, le nombre de prostatectomie robotique aux Etats-Unis est passé de 10 à 80%. Les applications de la chirurgie robotique abdominale sont en continuelle augmentation (1). Les premières indications étaient représentées par la chirurgie bariatrique avec la réalisation des by-pass où l’existence de plus amples degrés de liberté de mouvements des instruments permet la réalisation des anastomoses digestives avec une grande précision et sécurité. La voie robotique a ouvert de nouvelles voies telle la réalisation de thyroïdectomie sans incision cervicale mais par abord transaxillaire ,(2). En chirurgie digestive, les derniers sanctuaires à la coelioscopie sont représentés par la chirurgie hépatique et pancréatique. Les avantages de l’approche robotique peuvent probablement permettre de franchir ces réticences et ainsi permettre de vulgariser l’accès mini-invasif à ces procédures chirurgicales complexes. Au sein de notre équipe à Strasbourg, nous réalisons ces résections pancréatiques, hépatiques, ainsi que l’exérèse de certaines tumeurs duodénales par voie robotique (3-5).
La chirurgie robotique deviendra sûrement incontournable comme l’est devenue la coelioscopie, sous réserve d’amélioration technique et de réduction des coûts.
Références :
- Giulianotti PC, Sbrana F, Bianco FM, Elli EF, Shah G, Addeo P, et al. Robot-assisted laparoscopic pancreatic surgery: single-surgeon experience. Surg Endosc
- Brunaud L. Chirurgie aidée par un système robotique: une thyroïdectomie réalisée par voie transaxillaire à Nancy. Quotidien du médecin n°8686 ; 14/01/10
- Pessaux P, Diana M, Soler L, Piardi T, Mutter D, Marescaux J.Towards cybernetic surgery: robotic and augmented reality-assisted liver segmentectomy. Langenbecks Arch Surg. 2015 Apr;400(3):381-5.
- Ntourakis D, Marescaux J, Pessaux P. Robotic spleen preserving distal pancreatectomy: how I do it (with video). World J Surg. 2015 Jan;39(1):292-6.
- Pessaux P, Diana M, Soler L, Piardi T, Mutter D, Marescaux J. Robotic duodenopancreatectomy assisted with augmented reality and real-time fluorescence guidance. Surg Endosc. 2014 Aug;28(8):2493-8.
- Diana M, Pessaux P, Marescaux J. New technologies for single-site robotic surgery in hepato-biliary-pancreatic surgery. J Hepatobiliary Pancreat Sci. 2014 Jan;21(1):34-42.
- Ntourakis D, Marzano E, De Blasi V, Oussoultzoglou E, Jaeck D, Pessaux P. Robotic left pancreatectomy for pancreatic solid pseudopapillary tumor. Ann Surg Oncol. 2011 Mar;18(3):642-3.
- Marzano E, Ntourakis D, Addeo P, Oussoultzoglou E, Jaeck D, Pessaux P. Robotic resection of duodenal adenoma. Int J Med Robot. 2011;7:66-70.
- Addeo P, Marzano E, Nobili C, Bachellier P, Jaeck D, Pessaux P. Robotic Central Pancreatectomy With Stented Pancreaticogastrostomy: Operative Int J Med Robot. 2011 Sep;7(3):293-7
- Ntourakis D, Marzano E, Lopez Penza PA, Bachellier P, Jaeck D, Pessaux P. Robotic Distal Splenopancreatectomy: Bridging the Gap Between Pancreatic and Minimal Access Surgery. J Gastrointest Surg. 2010;14(8):1326-30